| Essentiels | ||
|---|---|---|
| 6.1 | Qu’est-ce que le pH ? | |
| 6.2 | Avec quoi mesure-t-on le pH ? | |
| 6.3 | Qu’est-ce qu’une solution acide ? | |
| 6.4 | Qu’est-ce qu’une solution basique ? | |
| 6.5 | Qu’est-ce qu’une solution neutre ? | |
| 6.6 | Comment s’appelle l’ion H⁺ ? l’ion HO⁻ ? | |
| 6.7 | Que se passe-t-il lorsqu’on mélange une base et un acide ? | |
| 6.8 | Dans une réaction chimique qu’est ce qu’un produit ? un réactif ? | |
| 6.9 | Que se passe-t-il lorsqu’on dilue une solution acide ou basique ? | |
1. Mesure de l’acidité
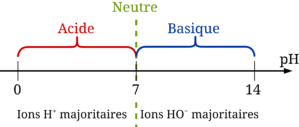
- pH
- Le pH est la mesure de l’acidité d’une solution. Il se mesure avec un pH-mètre ou avec du papier pH. Il n’a pas d’unité.
2. Dangers des acides et des bases
Les solutions très acides ou très basiques sont corrosives. Elles peuvent ronger les matériaux et les mains. Il faut donc porter des gants et des lunettes pour les manipuler.
3. Réaction chimique acide-base
Lorsqu’on mélange une solution acide avec une solution basique, les ions H⁺ réagissent avec les ions HO⁻ selon l’équation :
H⁺ + HO⁻ → H₂O
Les ions H⁺ et HO⁻ se neutralisent et forment de l’eau.